问题
填空题
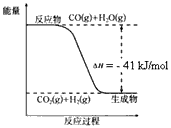
已知工业制氢气的反应为CO(g)+H2O(g)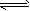 CO2(g)+H2(g),反应过程中能量变化如图所示。在500 ℃时的平衡常数K=9。若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态。
CO2(g)+H2(g),反应过程中能量变化如图所示。在500 ℃时的平衡常数K=9。若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态。
(1)增加H2O(g)的浓度,CO的转化率将_________(填“增大”“减小”或“不变”)。
(2)平衡常数的表达式K=_________。400℃时的平衡常数K________9(填“>”“<”或”“=”)。
(3)500℃时,10min内v(H2O)=_________,在此过程中体系的能量将_________(填“增加”或“减少”)__________kJ。
(4)已知2H2(g) + O2(g) = 2H2O(g) ΔH=-484kJ/mol 结合上图写出CO完全燃烧生成CO2的热化学方程式:___________________。
答案
(1)增大
(2)c(CO2)·c(H2)/ [c(CO)·c(H2O)];>
(3)0.0075mol/(L·min);减少;6.15
(4)CO(g)+1/2O2(g)==CO2(g) ΔH=-283kJ/mol
