问题
填空题
在一定温度下,向一个5L的密闭容器中,通入2 mol N2和8 mol H2及固体催化剂,使之反应。已知:
N2(g)+3H2(g)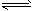 2NH3(g) ΔH=-92.2 kJ·mol-1。平衡时容器内气体压强为起始时的80%。
2NH3(g) ΔH=-92.2 kJ·mol-1。平衡时容器内气体压强为起始时的80%。
(1)计算平衡时容器内NH3的体积分数为________,该该温度下该反应的平衡常数为:________。(利用三段式计算,要有过程)
(2)加入2 mol N2和8 mol H2,达到平衡时,放出热量为________(填序号)。
A.大于92.2 kJ B.等于92.2 kJ C.小于92.2 kJ D.可能大于或小于或等于92.2 kJ
(3)在相同容器中,降低温度,通入2 mol NH3和1 mol H2及固体催化剂,反应达到平衡时NH3的体积分数是否为1/4,下列判断正确的是________(填序号)。
A.一定等于1/4 B.一定大于1/4 C.一定小于1/4 D.可能大于或小于或等于1/4
答案
(1)25%;0.16
(2)B
(3)D
