能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)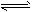 CH3OH(g) △H1
CH3OH(g) △H1
反应Ⅱ:CO2(g)+3H2(g)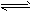 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
①上述反应符合“原子经济”原则的是____(填“I”或“Ⅱ”);
②用反应I生产燃料甲醇,该反应的化学平衡常数表达式为K=_________,下表所列数据是反应I在不同温度下的化学平衡常数(K)。

由表中数据判断△H1___0(填“>”“=”或“<”);
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.2
mol/L,则CO的转化率为_____,此时的温度为____(从上表中选择)。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g) +H2O(g) =CO2(g)+3H2(g) △H1 =+49. 0 kJ/mol
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) △H2
已知H2(g)+O2(g)=H2O(g) △H=-241.8 kJ/mol
则反应②的△H2=____kJ/mol;
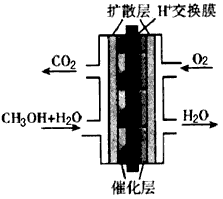
(3)下图是甲醇燃料电池的结构示意图。甲醇进入____极(填“正”或“负”),正极发生的电极反应为
___________________。
(1)①I;②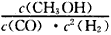 ;<;③80%;250℃
;<;③80%;250℃
(2)-192. 8
(3)负;O2+4H++4e-=2H2O
