问题
填空题
恒温下,将amolN2与bmolH2的混合气通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g)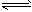 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始) ︰n(平)=
__________。
(4)原混合气体中,a︰b=__________。
(5)达到平衡时,N2和H2的转化率之比,α(N2) ︰α(H2)=___________。
(6)平衡混合气体中,n(N2) ︰n(H2) ︰n(NH3)=___________。
答案
(1)a=16
(2)8mol
(3)5︰4
(4)2︰3
(5)1︰2
(6)3︰3︰2
