(12分)50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液在下图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
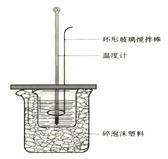
⑴大小烧杯间填或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)。其原因是 。
⑶大烧杯上如不满碎泡沫塑料的作用 。
⑵ (填“能”盖硬纸板,对求得中和热数值的影响是 (填“偏高”或“偏低”或“无影响”)。
⑷如果改用60 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量 (“增加”、“减少”或“不变”),所求中和热数值 (“增加”、 “减少”或 “不变”)。
(1)减少实验过程中的热量损失
(2) 不能 因金属易导热 (3)偏低 (4)增加 不变
在反应中必须尽可能的减少热量的损失,而金属属于热的良导体。所以不能将环形玻璃搅拌棒改为环形金属。若不盖硬纸板,会造成热量的损失,使结果偏低。因为酸和碱的物质的量增加了,所以放出的热量要增加,但中和热不变。