问题
计算题
在一定条件下,将一定量PCl5(g)通入密闭容器中,发生反应PCl5(g)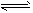 PCl3(g)+Cl2(g)。当达到平衡时,混合气体相对于H2的密度为74.5,则PCl3(g)在平衡混合气体中所占体积分数是?简述计算过程。
PCl3(g)+Cl2(g)。当达到平衡时,混合气体相对于H2的密度为74.5,则PCl3(g)在平衡混合气体中所占体积分数是?简述计算过程。
答案
解:设起始时通入PCl5(g)的物质的量为1 mol,达到平衡时消耗PCl5(g)的物质的量为x,则
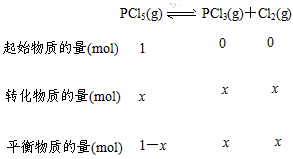
平衡时总物质的量为(1mol-x)+x+x=1 mol+x。由题意得平衡混合气体的平均摩尔质量
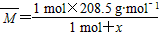 =74.5×2 g·mol-1,
=74.5×2 g·mol-1,
解得x=0.40 mol。
故PCl3(g)在平衡混合气体中所占体积分数为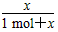 ×100%=
×100%=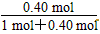 ×100%=28.6%
×100%=28.6%
