问题
填空题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列两组物质的熔点高低(填“>”或“<”):SiC_____Si,Si _____SiO2
(2)工业上高纯硅可通过下列反应制取: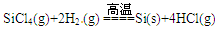 ,则2 mol H2生成高纯硅需_____ (填“吸收”或“放出”)能量_____ kJ。
,则2 mol H2生成高纯硅需_____ (填“吸收”或“放出”)能量_____ kJ。
(3)已知硅燃烧热的热化学方程式为Si(s)+O2(g)===SiO2(s) ΔH=-989.2kJ·mol-1,则O=O键键能为_____________。
答案
(1)> < (2)吸收 236 (3)498.8 kJ·mol-1
(1)化学键越强,分子越稳定,所以碳化硅的稳定性强于硅。单质硅的稳定性弱于二氧化硅的。
(2)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以该反应的反应热是360 kJ·mol-1×4+2×436 kJ·mol-1-4×431 kJ·mol-1-176 kJ·mol-1×2=236kJ·mol-1,所以是吸热反应.
(3)设O=O键键能为x,由键能可知176 kJ·mol-1×2+x-4×460 kJ·mol-1=-989.2kJ·mol-1,所以x=498.8 kJ·mol-1.
