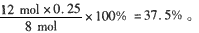问题
计算题
把4 mol N2和8mol H2置于5L密闭容器中合成氨,达到平衡时测得混合气体中NH3的体积分数为20%,
求:
(1)混合气体中H2的体积分数;
(2)反应前后容器内的压强比;
(3)N2和H2的转化率。
答案
(1)利用“差量法”,设N2的平衡转化率为x。
N2 +3H2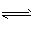 2NH3
2NH3
体积变化 1 2 2
转化/mol 4x 8x 8x
起始时加入反应物的总物质的量为4 mol+8 mol= 12 mol,
则反应后的总物质的量为:(12 - 8x)mol,即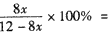 20%,
20%,
解得:x=0.25= 25%,
即N2的平衡转化率为25%。
故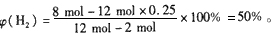
(2)根据阿伏加德罗定律,压强之比等于物质的量之比:
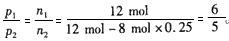
(3) H2的平衡转化率为: