已知反应:3I-(aq)+
(aq)⇌IS 2O 2-8
(aq)+ -3
(aq)2SO 2-4
(1)写出反应的平衡常数表达式K=______;
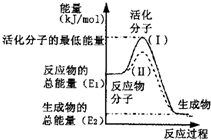
(2)如图表示反应过程中有关物质的能量,则反应的△H______0(填“>”、“<”或“=”);
(Ⅰ)、(Ⅱ)两线中,使用催化剂的是______线;
(3)反应中发生反应的I-与被氧化的I-的物质的量比为______;
(4)反应的速率可以用
与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,记录的数据如下:I -3
| 实验编号 | ① | ② | ③ | ④ | ⑤ | ||
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 | ||
c(
| 0.040 | 0.040 | 0.080 | 0.080 | 0.040 | ||
| t/s | 88 | 44 | 22 | 11 | t1 |
(1)反应3I-(aq)+
(aq)⇌IS 2O 2-8
(aq)+ -3
(aq)的平衡常数k=2SO 2-4
,故答案为:c
)•c2(I -3
)(SO 2-4 c3(I-)•c
)(S2O 2-8
;c
)•c2(I -3
)(SO 2-4 c3(I-)•c
)(S2O 2-8
(2)由图可知,反应物的总能量高于生成物的总能量,该反应为放热反应,所以△H<0;
催化剂降低活化能,改变反应途径,提高反应速率,但不影响反应热,故(Ⅱ)表示使用催化剂,
故答案为:<;(Ⅱ);
(3)根据方程式可知,I3-可看做I2和I-相结合形成的微粒,故发生反应的I-与被氧化的I-的物质的量比为3:2,故答案为:3:2;
(4)由题目中表格数据可分析出c(I-)、c(S2O32-)浓度越大,反应速率越快,显蓝色所需时间越少,故实验目的应是研究反应物I-与S2O82-的浓度对反应速率的影响.
对比数据组①和②、③和④,可以看到,c (S2O82-)不变,c (I-)增大到2倍时,反应时间缩短了一半,即反应速率加快了一倍;
对比数据组②和③,可以看到,c (I-)不变,c (S2O82-)增大到2倍时,反应时间缩短了一半,即反应速率也加快了一倍;
对比数据组对比数据组①和③,可以看到,c (I-)和c (S2O82-)均增大到2倍时,反应时间为原反应时间的1/4,即反应速率加快了4倍.
可见两个反应物的浓度和反应速率之间的数学关系是:反应物浓度每增加一倍,反应时间就减少一倍,对于两个反应物来说都是如此,
可得出结论:反应速率与反应物起始浓度乘积成正比.
对比实验①和⑤,实验⑤的c (I-)为实验①的4倍,而c (S2O82-)保持不变,则由此可计算实验⑤的反应时间应为实验①反应时间的1/4,即t1=88s×
=22s.1 4
故答案为:研究反应物I-与S2O82-的浓度对反应速率的影响;22s;反应速率与反应物起始浓度乘积成正比.
