在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如表格:
| 时间/s 浓度mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4)mol•L-1 | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2)/mol•L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)达到平衡时N2O4的转化率为______%,表中c2______c3,a______b (选填“>”“<”“=”).
(2)20s的四氧化二氮的浓度c1=______mol•L-1,在0s~20s内四氧化二氮的平均反应速率为______mol•(L•s)-1;.
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是______mol•L-1.
(1)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4
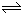
2 NO2,
浓度变化:0.06mol/L 0.120mol/L
所以平衡时N2O4的转化率为
×100%=60%;0.06mol/L 0.1mol/L
c3=0.1mol/L-0.06mol/L=0.04mol/L,
由表可知,40s时,c(N2O4 )=0.050mol/L,
N2O4
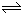
2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c3;
60s后反应达平衡,反应混合物各组分的浓度不变,所以a=b.
故答案为:60;>;=
(2)由表可知,20s时,c(NO2 )=0.060mol/L,所以
N2O4
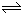
2 NO2,
浓度变化:0.03mol/L 0.060mol/L
所以20s的四氧化二氮的浓度c1=0.1mol/L-0.03mol/L=0.07mol/L;
在0s~20s内四氧化二氮的平均反应速率为v(N2O4)=
=0.0015mol•(L•s)-1.0.03mol/L 20s
故答案为:0.07mol/L;0.0015mol•(L•s)-1.
(3)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L.
所以 N2O4
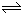
2 NO2,
0.1mol/L 0.20mol/L
故答案为:0.20mol/L
