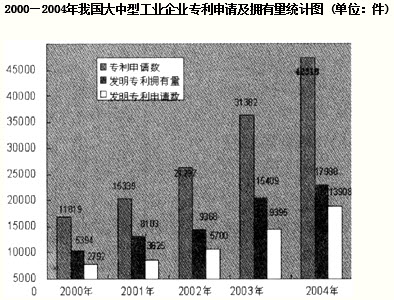
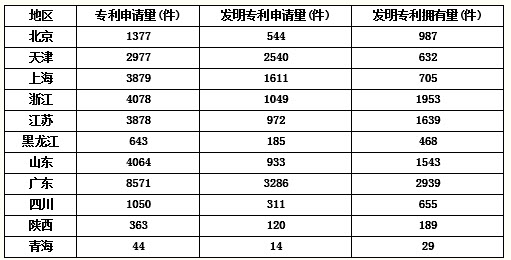
一氧化碳是一种重要的化工原料.
(1)高炉炼铁中发生的反应之一是:FeO(s)+CO(g)
Fe(s)+CO2(g),△H=-1kJ/mol.温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比将______(填“增大”、“减小”或“不变”). 加热 .
已知1100℃时,该反应平衡常数K=0.263,现测得高炉中(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时该反应______.
A.向正反应向向进行 B.处于平衡状态 C.向逆反应方向进行
(2)合成氨工业中需将原料气中的CO变成CO2除去.在密闭密器中将CO和H2O混合加热到800℃,达到下列平衡:
CO(g)+H2O(g)
CO2(g)+H2(g) K=1.0,若平衡时n(H2O)/n(CO)=1,则CO转化为CO2的转化率为______. △ .
(3)用CO和H2经如下两步反应制得甲酸甲醛:CO+2H2→CH3OH,CO+CH3OH→HCOOCH3已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则2.52tCO最多可制得甲酸甲醛多少吨?(写出计算过程).
(1)反应放热,升高温度平衡向逆反应方向移动,则平衡常数应减小,(CO2)=0.025mol/L,c(CO)=0.1mol/L,
Q=
=0.25<0.263,反应向正反应方向进行,0.025 0.1
故答案为:减小;A;
(2)若平衡时n(H2O)/n(CO)=1,根据反应方程式可知,起始时H2O和CO物质的量相等,设H2O和CO的物质的量都为1mol
平衡时转化xmolCO,
CO(g)+H2O(g)
CO2(g)+H2(g) △ .
起始(mol):1 1 0 0
转化(mol):x x x x
平衡(mol):1-x 1-x x x
则
=1,x2 (1-x)2
x=0.5,
则CO转化为CO2的转化率为
×100%=50%,0.5 1
故答案为:50%;
(3)n(CO)=
=9×104mol,2.52×106g 28g/mol
设用于制备甲醇的CO物质的量为x,用于和甲醇反应的CO为y,
则
,x+y=9×104mol 80%x=y
x=5×104mol,y=4×104mol,
n(HCOOCH3)=4×104mol×85%=3.4×104mol,
m(HCOOCH3)=3.4×104mol×60g/mol=2.04×106g=2.04t,
答:2.52tCO最多可制得甲酸甲醛2.04t.