问题
问答题
在一定温度下,10L密闭容器中加入5.0mol SO2、4.5mol O2,经10min后反应达平衡时O2的浓度为0.30mol/L.请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)容器内反应前与平衡时的压强之比(最简整数比);
(3)平衡常数K.
答案
10L密闭容器中加入5.0molSO2、4.5molO2,c(SO2)=0.50mol/L,c(O2)=0.45mol/L,经10min后反应达平衡时O2的浓度为0.30mol/L,
则 2SO2+O2
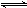
2SO3
起始浓度(mol/L) 0.50 0.45 0
变化浓度(mol/L) 0.30 0.15 0.30
平衡浓度(mol/L) 0.20 0.30 0.30
(1)10min内SO2的转化率为
×100%=60%,答:10min内SO2的转化率为60%;0.3mol/L 0.5mol/L
(2)同温同压下,物质的量与压强成正比,则容器内反应前与平衡时的压强之比为
=19:16,5mol+4.5mol (0.2+0.3+0.3)×10mol
答:容器内反应前与平衡时的压强之比为19:16;
(3)平衡常数K=
=c(SO3)2 c(O2)×c(SO2)2
=7.5L/mol,答:平衡常数K为7.5L/mol.(0.3mol/L)2 (0.2mol/L)2×0.3mol/L
