(13分)①判断下列描述的正误(正确的打“√”,错误的打“×”)。
(1)1 mol酸与1 mol碱完全反应放出的热量是中和热。( )
(2)物质具有的能量越高,物质的稳定性越强。( )
(3)化学反应的过程,既遵循质量守恒定律,也遵循能量守恒定律。( )
(4)在确定的化学反应体系中,反应物的总能量与生成物的总能量一定不同。( )
(5)需要加热才能进行的反应一定是吸热反应。( )
②已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=== 2CO2(g)+2H2O(l) △H1=" -" 870.3 kJ• mol-1
(2)C(s)+O2(g) === CO2(g) △H= -393.5kJ• mol-1
(3)H2(g)+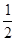 O2(g) === H2O(l) △H=" -" 285.8kJ• mol-1
O2(g) === H2O(l) △H=" -" 285.8kJ• mol-1
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g) ===CH3COOH(l) △H= _____________。
(13分)① ×、×、√、√、× ②-488.3kJ• mol-1
①考查反应热的有关判断。
中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以(1)是不正确的;物质具有的能量越低,物质的稳定性越强,因此(2)不正确;质量守恒定律和能量守恒定律,是化学反应必须遵循的两个基本定律,(3)正确;任何化学反应都伴随着能量的变化,所以在确定的化学反应体系中,反应物的总能量与生成物的总能量一定不同,(4)正确;反应是放热反应还是吸热反应,与反应条件是无关的,只与反应物和生成物总能量的相对大小有关系,(5)不正确。
②考查反应热的有关计算。
根据盖斯定律可知,(3)×2+(2)×2-(1)即得到反应2C(s)+2H2(g)+O2(g) ===CH3COOH(l) ,所以该反应的反应热△H=-285.8kJ• mol-1×2-393.5kJ• mol-1×2+870.3 kJ• mol-1=-488.3kJ• mol-1。
