问题
问答题
将平均摩尔质量为8.5g/mol的N2和H2的混合气体投入恒温恒压容器中,反应达平衡时,气体体积减少40%,求
①投入的N2和H2的体积比;
②N2的转化率.
答案
①利用十字交叉法计算投入的N2和H2的体积比:
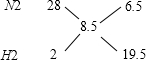
所以N2和H2的体积比为 6.5:19.5=1:3.
答:N2和H2的体积比为1:3.
②设N2和H2投入量分别为1和3mol,反应的N2为xmol,则
N2 +3H2

2NH3
开始(mol):1 3 0
变化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
=4 4-2x
,解得x=0.8mol100 60
所以α(N2)=
×100%=80%.0.8mol 1mol
答:N2的转化率80%.

