问题
问答题
在常压和500℃时把O2和SO2按 1:2 体积比混合,如果混合前O2有 10mol,平衡时SO3占总体积的91%,求:
(1)平衡时有多少摩O2转化?
(2)混合气中SO2的体积分数.
(3)SO2的转化率.
(4)若保持与前面相同的条件,改用20molSO3代替O2和SO2,则达平衡时O2的体积分数为多少?
答案
令参加反应的氧气的物质的量为nmol,根据三段式解题法,用n表示求出混合气体各组分物质的量的变化量、平衡时各组分的物质的量.
2SO2(g)+O2(g)
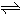
2SO3(g).
开始(mol):20 10 0
变化(mol):2n n 2n
平衡(mol):20-2n 10-n 2n
(1)平衡时SO3占总体积的91%,所以
×100%=91%2n 20-2n+10-n+2n
解得,n=9.38
答:平衡时有9.38molO2转化.
(2)混合气中SO2的体积分数为
×100%=6%.20-2×9.38 30-9.38
答:混合气中SO2的体积分数为6%.
(3)SO2的转化率为
×100%=93.8%.2×9.38 20
答:SO2的转化率为93.8%.
(4)与原平衡等效,所以平衡时O2体积分数为
×100%=3%.10-9.38 30-9.38
答:平衡时O2体积分数为3%.
