氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
(1)合成氨的原理为:N2(g)+3H2⇌2NH3△H=-92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1mol,H2为0.3mol,NH3为0.1mol.该条件下H2的转化率为______.此温度下该反应的平衡常数K=______
②欲提高H2的转化率,下列措施可行的是______.
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
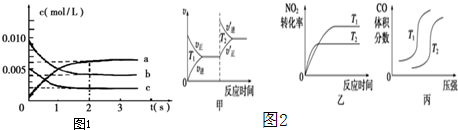
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)═2NO2(g)△H<0体系中,各成分浓度随时间的变化如图1所示:
①用O2表示从0~2s内该反应的平均速率v=______.
②能说明该反应已经达到平衡状态的是______.
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是______.
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效的催化剂
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体
4CO(g)+2NO2(g)⇌4CO2(g)+N2(g)△H=-1200kJ•mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,图2中图象(甲、乙、丙)正确的是______(填代号)
(1)根据化学方程式和三段式列式计算:
N2(g)+3H2(g)⇌2NH3(g)
初始浓度;0.6 0.450
变化浓度:0.50.15 0.1
平衡浓度:0.10.3 0.1
该条件下H2的转化率=
×100%≈33.3%,0.15mol/L 0.45mol/L
平衡常数K=
=c2(NH3) c(N2)c3(H2)
=3.7(L/mol)20.12 0.1×0.33
故答案为:33.3%;3.7(L/mol)2;
③根据化学平衡:N2(g)+3H2(g)⇌2NH3(g),反应是气体体积减小的放热反应,欲提高 H2的转化率,平衡正向进行;
a.向容器中按原比例再充入原料气,则压强增大,平衡向右移动,氢气的转化率增大,故a正确;
b.向容器中再充入惰性气体,则各组分浓度不变,平衡不移动,氢气的转化率不变,故b错误;
c.改变反应的催化剂,不影响平衡的移动,氢气的转化率不变,故c错误;
d.液化生成物分离出氨,平衡向右移动,氢气的转化率增大,故d正确;
故选ad.
(2)①由图象数据可知,由方程式2NO(g)+O2(g)⇌2NO2(g)可知,平衡时△c(NO):△c(O2):△c(NO2)=2:1:2,为据此判断表示,浓度变化的曲线,分别为b为NO,c为O2,aNO2,由图中数据可知2s内,O2的浓度变化量为0.005mol/L-0.002mol/L=0.003mol/L,根据v=
计算v(O2)=△c △t
=0.0015mol/L•min;0.003mol/L 2L
故答案为:0.0015mol/L•min;
②能说明该反应已经达到平衡状态的是当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变;
a.未指明正逆速率,若都为同一方向速率,始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,若为不同方向的速率,速率之比等于化学计量数之比,说明到达平衡,故a错误;
b.随反应进行气体的物质的量减小,压强增减小,容器内压强保持不变,说明到达平衡,故b正确;
c.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆(NO)=2v正(O2),说明到达平衡,故c正确;
d.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,故d错误;
故选bc;
③为使该反应的反应速率增大,且平衡向正反应方向移动依据平衡移动原理分析判断;
a.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,故a错误;
b.适当升高温度,反应速率增大,平衡向逆反应移动,故b错误;
c.增大O2的浓度,反应速率增大,平衡向正反应移动,故c正确;
d.选择高效的催化剂,增大反应速率,不影响平衡移动,故d错误;
故选C;
(3)甲:升高温度,化学平衡逆向移动,化学反应速率会迅速增大,会离开原来的速率点,故甲错误;
乙:升高温度,化学反应速率会迅速增大,所以T2时先达到化学平衡状态,并且化学平衡逆向移动,二氧化氮的转化率减小,故乙正确;
丙:对于反应:4CO(g)+2NO2(g)⇌4CO2(g)+N2(g),T不变,增大压强,平衡正向移动,一氧化碳的体积分数会减小,故丙错误.
故答案为:乙.
