已知298K时:
反应Ⅰ:2H2(g)+O2(g)=2H2O(g)△H=-484.0kJ•mol-1
反应Ⅱ:CO(g)+1/2O2(g)⇌CO2(g)△H=-283.0kJ•mol-1
(1)298K时,将amolCO2与bmolH2混合气体充入容积为1L的密闭容器中,2min后反应达到平衡状态时测得产物CO的浓度为cmol•L-1.则:
①v(H2)=______.
②CO2与H2发生反应生成CO和水蒸气的热化学方程式为______.若不同温度下发生上述反应,其化学平衡常数K(700℃)______K(830℃)(填写“<”、“>”或“=”)
(2)向容积为1L的密闭容器中加入0.050molCO和0.025molO2,在一定温度下发生反应Ⅱ,达平衡后测得c(CO2)=0.040mol•L-1.则:①能说明反应Ⅱ已经达到化学平衡状态的是______(填写序号).
a.v(CO2)=2v(O2)b.容器内压强保持不变
c.v逆(CO)=2v正(O2)d.容器内气体的密度保持不变
②该温度条件下,反应Ⅱ的化学平衡常数K=______.
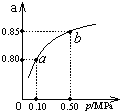
③某温度下,CO的平衡转化率(a)与体系总压强(P)的关系如下图所示.
平衡状态由a变到b时,平衡常数K(a)______K(b)(填“>”、“<”或“=”).
(1)已知298K时:
反应Ⅰ:2H2(g)+O2(g)=2H2O(g)△H=-484.0kJ•mol-1
反应Ⅱ:CO(g)+1/2O2(g)⇌CO2(g)△H=-283.0kJ•mol-1
利用盖斯定律将Ⅰ×
-Ⅱ可得CO2(g)+H2(g)⇌CO(g)+H2O(g)△H=+41.0kJ•mol-1,1 2
①v(H2)=v(CO)=
=cmol/L 2min
mol•L-1•min-1,c 2
故答案为:
mol•L-1•min-1;c 2
②由以上分析可知,CO2与H2发生反应生成CO和水蒸气的热化学方程式为CO2(g)+H2(g)⇌CO(g)+H2O(g)△H=+41.0kJ•mol-1,因正反应吸热,则升高温度平衡向正方向移动,平衡常数增大,
故答案为:CO2(g)+H2(g)⇌CO(g)+H2O(g)△H=+41.0kJ•mol-1;<;
(2)①对于CO(g)+1/2O2(g)⇌CO2(g)△H=-283.0kJ•mol-1,
a.无论是否达到平衡状态都存在v(CO2)=2v(O2),故a错误;
b.由于反应前后气体的物质的量不等,则容器内压强保持不变,可说明达到平衡状态,故b正确;
c.v逆(CO)=2v正(O2),可说明正逆反应速率相等,达到平衡状态,故c正确;
d.无论是否达到平衡状态,容器内气体的密度保持不变,故d错误.
故答案为:bc;
②CO(g)+
O2(g)⇌CO2(g)1 2
开始(mol/L):0.05 0.025 0
转化(mol/L):0.04 0.02 0.04
平衡(mol/L):0.01 0.005 0.04
则k=
=56.56,0.04 0.01× 0.005
故答案为:56.56;
③平衡常数只是温度的函数,与压强无关,平衡常数不变,故答案为:=.
