红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的△H表示生成
1mol产物的数据)
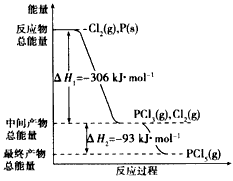
根据上图回答下列问题:
(1)P和Cl2反应生成PC13的热化学方程式是________________________
(2)PCl5分解成PCl3和Cl2的热化学方程式是________________________,上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0. 80 mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率al等于
__________;若反应温度由T1升高到T2,平衡时PCl5的分解率为a2,a2_________a1(填“大于”、“小 于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是______________________________
(4)P和Cl2分两步反应生成l mol PCl5的△H3=_____________,P和Cl2一步反应生成1 mol PCl5的△H4
_______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_______________________。
(1)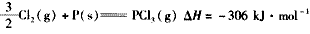
(2)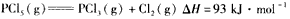 ;25%;大于
;25%;大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399kJ/mol;等于
(5)PCl5+4H2O==H3PO4+5HC1
