(12分)下 * * 个反应在某密闭容器中进行:
反应① Fe(s)+CO2(g) FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1
反应② 2CO(g)+O2(g) 2CO2(g) △H2=" b" kJ·mol-1
2CO2(g) △H2=" b" kJ·mol-1
反应③ 2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1)则△H3= (用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积
B.再通入CO2
C.升高温度
D.使用合适的催化剂(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为: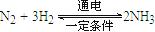 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
(1)(2a+b)kJ·mol-1
(2)50% ;(3)>(1);BC(4)阳 N2+6H++6e =2NH3) (5)中,大于。
=2NH3) (5)中,大于。
题目分析:盖斯定律的应用。反应热也遵守盖斯定律,可以看到
反应③=2①+ ② 所以(1)则△H3=(2a+b)kJ·mol-1
Fe(s)+CO2(g) FeO(s)+CO(g)
FeO(s)+CO(g)
起始物质的量浓度 1 1 0 0
变化物质的量浓度 x x x x
平衡物质的量浓度 1-x 1-x x x
已知500℃时反应①的平衡常数K=1.0=x/(1-x) 所以x=0.5 达到平衡时CO2的转化率为100%x/(1-x)=50%
将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,平衡向正反应方向移动,说明该反应是吸热反应,则a>0 ;为了加快化学反应速率且使体系中CO的物质的量增加,平衡必需向正向移动,而反应前后气体体积不变化,所以可以采取的措施有
再通入CO2 ;升高温度 ,使用催化剂,只能改变化学反应速率,但是平衡不会移动。
 从化合价的变化上可以看到氢气的化合价升高,做还原剂,所以在电解法合成氨的过程中,应将H2不断地通入阳极;在另一电极通入N2,该电极反应式为
从化合价的变化上可以看到氢气的化合价升高,做还原剂,所以在电解法合成氨的过程中,应将H2不断地通入阳极;在另一电极通入N2,该电极反应式为
N2+6H++6e =2NH3 在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),根据质子守恒,知道氢离子和氢氧根的浓度也相等,所以溶液显中性, 可推断a 大于0.01,如实等体积等浓度混合,溶液也会显示酸性,所以显示中性,a 必须大于0.01
=2NH3 在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),根据质子守恒,知道氢离子和氢氧根的浓度也相等,所以溶液显中性, 可推断a 大于0.01,如实等体积等浓度混合,溶液也会显示酸性,所以显示中性,a 必须大于0.01
点评:此题综合性很强,考查知识点广。盖斯定律的内容为:在定压定容条件下,任意一个反应其总反应的热效应只与反应的始态和终态有关而与反应的路程无关。只要学生学习过程中牢记并理解这些基本定义,便不难解答此题。
