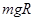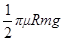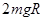问题
问答题
计算题:在密闭容器中进行的如下反应:2SO2(g)+O2(g)⇌2SO3(g).SO2的起始浓度是0.4mol/l,O2的起始浓度是1mol/l,当SO2的转化率为50%时,反应达到平衡状态.
(1)求SO2的转化浓度
(2)求反应的平衡常数
(3)求O2的转化率.
答案
SO2的起始浓度是0.4mol/l,当SO2的转化率为50%时,转化的SO2为0.4mol/L×50%=0.2mol/L,
2SO2(g)+O2(g)⇌2SO3(g)
开始 0.4 1 0
转化 0.2 0.1 0.2
平衡 0.2 0.9 0.2
(1)转化的SO2为0.4mol/L×50%=0.2mol/L,答:SO2的转化浓度为0.2mol/L;
(2)由平衡时各物质的浓度,则K=
=1.1,答:反应的平衡常数为1.1;(0.2mol/L)2 (0.2mol/L)2×0.9mol/L
(3)O2的转化率为
×100%=10%,答:O2的转化率为10%.0.1mol/L 1mol/L

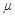 ,物体全程克服摩擦力做功为
,物体全程克服摩擦力做功为