(1)某温度下,在一密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如下图所示.分析有关数据,写出X、Y、Z反应的化学方程式______.
(2)下列情况可以证明(1)中的反应已达到平衡状态的是______(填序号).
A.物质的浓度:c(X)=c(Y)=c(Z)
B.温度和体积一定时,某一生成物浓度不再变化
C.温度和体积一定时,容器内的压强不再变化
D.温度和体积一定时,混合气体的平均相对分子质量不再变化
(3)某温度下,在另一密闭容器中充入2molX和3molY,然后按(1)中化学方程式进行反应,当达到平衡时,测得Z的物质的量分数为25%,则平衡时X的转化率为______.
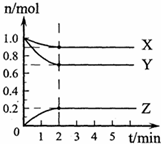
(1)由图象可知,X、Y、Z同在2min内物质的量的变化量之比为(1-0.9):(1-0.7):(0.2-0)=1:3:2,
其比值等于化学反应速率之比,也等于化学计量数之比,且由图象可知,2min达到平衡,则该反应为X+3Y⇌2Z,故答案为:X+3Y⇌2Z;
(2)化学平衡的特征为“定”、“等”,则
A.物质的浓度:c(X)=c(Y)=c(Z),取决于起始浓度及转化率,不能说明反应达到平衡,故A不选;
B.温度和体积一定时,某一生成物浓度不再变化,为平衡的“定”特征,则反应达到化学平衡,故B选;
C.温度和体积一定时,容器内的压强不再变化,为平衡的“定”特征,则反应达到化学平衡,故C选;
D.温度和体积一定时,混合气体的平均相对分子质量不再变化,为平衡的“定”特征,则反应达到化学平衡,故D选;
故答案为:BCD;
(3)由(1)可知,反应为X+3Y⇌2Z,
开始 2 3
转化 x 3x 2x
平衡2-x 3-3x 2x
平衡时,测得Z的物质的量分数为25%,则
×100%=25%,2x 2-x+3-3x+2x
解得x=0.5mol,则X的转化率为
×100%=25%,故答案为:25%.0.5mol 2mol
