在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(2)n3______n4(填“>”、“<”或“=”),该反应的平衡常数值为______;
(3)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是______mol/L,假设在80s时达到平衡,请在如图所示的图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.
(4)在(3)中条件下达到平衡后四氧化二氮的转化率为______.
(5)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2⇌N2O4的平衡常数将______(填“增大”、“减小”或“不变”)
(1)由表中数据可知,从反应开始直至20s时,v(N2O4)=
=0.075mol•L-1•min-1,则v(NO2)=2v(N2O4)=2×0.075mol•L-1•min-1=0.015mol•L-1•min-1,0.05mol 2L 20s 60s/min
故答案为:0.15;
(2)反应达到60s时达到化学平衡状态,二氧化氮的物质的量不再变化,所以n3=n4,
根据反应方程式计算:2NO2 ⇌N2O4
初始:0.4mol 0
转化:0.16mol 0.08mol
平衡:0.24mol 0.08mol
则平衡时的浓度分别为:c(N2O4)=
=0.04mol/L,c(NO2)=0.08mol 2L
=0.12mol/L,0.24mol 2L
k=
=c(N2O4) c(NO2)
=2.8(mol/L)-1,0.04mol/L 0.12mol/L×0.12mol/L
故答案为:=;2.8;
(3)根据反应 2NO2 ⇌N2O4可知,0.4molNO2与0.2molN2O4相当,若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是:
=0.1mol/L;从放入N2O4到平衡时需要80s,初始加入的N2O4为0.2mol,物质的量浓度为0.1mol/L,二氧化氮浓度为0;终点N2O4的浓度为0.04mol/L,终点二氧化氮浓度为0.12mol/L,图象可取20s,40s,80s等几个点用平滑曲线来连接,该条件下此反应中N2O4和NO2的浓度随时间变化的曲线为:0.2mol 2L 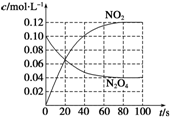 ,故答案为:0.1mol/L;
,故答案为:0.1mol/L; ;
;
(5)根据等效平衡,在(4)中条件下达到平衡后四氧化二氮的物质的量为0.08mol,与充入二氧化氮为相同平衡状态,则反应的四氧化二氮的物质的量为0.2mol-0.08mol=0.012mol,所以达到平衡后四氧化二氮的转化率为转化率为:
=60%,0.012mol 0.2mol
故答案为:60%;
(6)升高温度,气体颜色会变深,说明升高温度平衡向左移动,二氧化氮浓度增大,四氧化二氮浓度减小,化学平衡常数减小,故答案为:减小.
