(1)P4(白磷,s)+5O2(g)══ P4O10(s) ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)══ 1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 ,
相同状况下,红磷的稳定性比白磷 (填“强”、“弱”或“无法判断”)
(2)在原电池中,通常较活泼的金属做 极,发生 反应;
电解池中,与电源正极相连的极是 极,发生 反应。
(3)右图所示水槽中试管内有一枚铁钉,放置数天后观察:
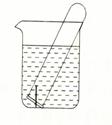
①若试管内液面上升,发生 腐蚀,正极反应式为 。
②若试管内液面下降,发生 腐蚀,正极反应式为 。
(1)P4(白磷,s)=4P(红磷,s) ΔH=-29.2 kJ/mol(2分)
强 (1分) (2)负 、 氧化 、 阳 、 氧化 (各1分)
(3)吸氧 (1分) O2+4e-+2H2O=4OH- (2分)
析氢 (1分) 2H++2e-=H2 ↑ (2分)
题目分析:(1)根据盖斯定律可知,①-②×4即得到P4(白磷,s)=4P(红磷,s),所以该反应的反应热ΔH=-2983.2kJ/mol+738.5kJ/mol×4=-29.2 kJ/mol。这说明白磷的总能量高于红磷的总能量,所以红磷稳定性强于白磷的。
(2)在原电池中,通常较活泼的金属做负极,失去电子,发生氧化反应;在电池中,与电源正极相连的极是阳极,失去电子,发生氧化反应。
(3)①若试管内液面上升,说明试管内压强减小,氧气被消耗,因此是吸氧腐蚀,正极反应式是O2+4e-+2H2O=4OH-。
②若试管内液面下降,说明试管内压强增大,有气体生成,因此是析氢腐蚀,正极反应式是2H++2e-=H2↑。
点评:该题是基础性试题的考查,难度不大。主要是考查学生对基础基础知识的了解掌握情况,以及灵活运用基础知识解决实际问题的能力。该题的关键是掌握好电化学原理以及有关的应用,有利于培养学生的逻辑思维能力和应试能力。
