373K时,某1L密闭容器中发生如下可逆反应:A(g)⇌2B(g).其中物质B的物质的量变化如图所示
(1)已知373K时60s达到平衡,则前60s内A的平均反应速率为______.
(2)若373K时B的平衡浓度为A的3倍,473K时(其他条件不变),B的平衡浓度为A的2倍,请在上图中画出473K时A的物质的量随时间的变化曲线.
(3)若反应在373K进行,在1L密闭容器中加入1molB、0.2molHe,达到平衡时B的转化率应______.
A.等于60%B.等于40%C.小于40%D.介于40%~60%之间
(4)已知曲线上任意两点之间边线的斜率表示该时段内B的平均反应速率(例如直线EF的斜率表示20s~60s内B的平均反应速率),试猜想曲线上任意一点的切线斜率的意义______.
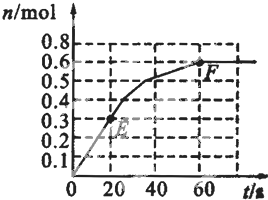
(1)由图可知,前60s内B的物质的量变化为0.6mol,根据方程式A(g)⇌2B(g)可知△n(A)=
×0.6mol=0.3mol,所以v(A)=1 2
=0.005mol/(L•s),0.3mol 1L 60s
故答案为:0.005mol/(L•s);
(2)由图可知,60s达平衡时B的物质的量变化为0.6mol,根据方程式A(g)⇌2B(g)可知△n(A)=0.3mol,B的平衡浓度为A的3倍,体积不变,浓度之比等于物质的量之比,故此时A的物质的量0.6mol×
=0.2mol,所以A的起始物质的量为0.3mol+0.2mol=0.5mol,1 3
473K时(其他条件不变),B的平衡浓度为A的2倍,体积不变,浓度之比等于物质的量之比,令平衡时B的物质的量为amol,则A的物质的量变化为0.5amol,故(0.5mol-0.5amol)×2=amol,解得a=0.5,故平衡时A的物质的量为0.5×0.5mol=0.25mol,温度升高反应速率加快,故473K时反应到达平衡的时间小于60s,图象为: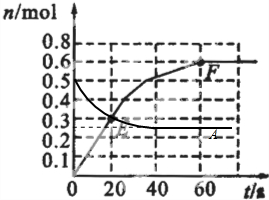
故答案为: ;
;
(3)恒温恒容稀有气体不影响平衡,加入1molB,等效为加入0.5molA,与原平衡等效,平衡时B的物质的量相同为0.6mol,参加反应B的物质的量为1mol-0.6mol=0.4mol,故B的转化率为
×100%=40%,故选B;0.4mol 1mol
(4)曲线上任意一点的切线斜率表示该时刻的即时反应速率,故答案为:表示该时刻的即时反应速率.
