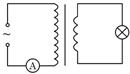
降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,先进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(L•min);
②氢气的转化率=______;
③该反应的平衡常数为______(保留小数点后2位);
④下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是______.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1molCO2和3molH2.
(1)①利用三段式解题法计算
CO2(g)+3H2(g) CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 30 0
变化(mol/L):0.75 2.250.75 0.75
平衡(mol/L):0.25 0.75 0.750.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
=0.225mol•L-1•min-1,2.25mol/L 10min
故答案为:0.225;
②氢气的转化率=
×100%=75%,2.25 3
故答案为:75%;
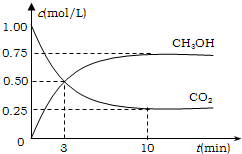
②平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=
=c(CH3OH)c(H2O) c(CO2)c3(H2)
=5.33,0.75×0.75 0.25×0.753
故答案为:5.33;
③要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故D错误.故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1molCO2和3molH2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD.

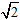 sin100πt (V)的 正弦交流电源,图中电流表内阻不计.副线圈接入“110V,60W”灯泡一只,且灯光正常发光.下列说法正确的是( )
sin100πt (V)的 正弦交流电源,图中电流表内阻不计.副线圈接入“110V,60W”灯泡一只,且灯光正常发光.下列说法正确的是( ) /22 A
/22 A