问题
选择题
已知
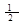 (1)H2(g)+ O2(g)===H2O(g) △H1=a kJ·mol-1
(1)H2(g)+ O2(g)===H2O(g) △H1=a kJ·mol-1
(2)2H2(g)+O2(g)===2H2O(g) △H2=b kJ·mol-1
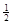 (3)H2(g)+ O2(g)===H2O(l) △H3=c kJ·mol-1
(3)H2(g)+ O2(g)===H2O(l) △H3=c kJ·mol-1
(4)2H2(g)+O2(g)===2H2O(l) △H4=d kJ·mol-1
下列关系式中正确的是( )
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
答案
答案:C
题目分析:由于氢气与氧气反应属于放热反应,所以△H<0,故BD错误,将(1)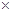 2得到(2),所以2a=b<0,故C正确。,由于H2O(g)转化为H2O(l)要放热,所以c<a<0,故A错误,答案为C。
2得到(2),所以2a=b<0,故C正确。,由于H2O(g)转化为H2O(l)要放热,所以c<a<0,故A错误,答案为C。
点评:该题是基础性试题的考查,属于高考中的常见考点之一,解答的关键是要弄清楚△H的符号表示关系,即吸热是大于0,放热是小于0。
