工业上在催化剂作用下可利用CO合成甲醇:CO(g)+2H2(g) CH3OH(g),图1表示反应过程中能量的变化情况。
CH3OH(g),图1表示反应过程中能量的变化情况。

请回答下列问题:
(1)在图I中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)为探究外界条件对合成甲醇化学反应速率的影响规律,某科技工作者设计了以下三组实验,部分数据已填人表中,请补充完整。
| 实验组 | T/℃ | 起始浓度/mol•L-1 | 等质量催化剂的 比表面积/m2•g-1 | |
| CO | H2 | |||
| ① | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 350 | 124 | ||
其中设计实验组①和②的目的是______。
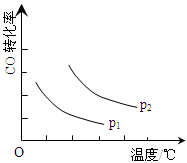
(3)“图2”所揭示的规律是:在p1压强达平衡时______;并请画出在p2压强下(p2> p1)的曲线。
(4)在碱性条件下可将合成甲醇的反应设计成原电池,则负极的电极反应式为______。
(15分)
(1)b(2分) 放热(2分)
(2)1.20×10-3(1分) 5.80×10-3(1分) 探究等质量催化剂的比表面积不同时对合成甲醇化学反应速率的影响规律(2分,其它合理答案也给分)
(3)CO的转化率随温度的升高而降低(2分)
(4)H2 —2e-+2OH-=2H2O(3分)
题目分析:(1)读图1,催化剂能降低反应的活化能,曲线a代表正或逆反应的活化能高于曲线b,所以b表示使用了催化剂,a表示未使用催化剂;放热反应中反应物总能量高于生成物总能量,吸热反应中反应物总能量低于生成物总能量,图中1molCO和2molH2的总能量高于1molCH3OH(g)的总能量,所以该反应是放热反应,△H=—91kJ/mol;(2)只改变一个变量进行探究,才能更快得外界条件影响化学反应速率的规律,这是设计实验的基本原则,实验②③的温度分别是280℃、350℃,则CO和H2的起始浓度、等质量催化剂的比表面积都应该相同,所以CO和H2的起始浓度分别为1.20×10-3mol/L、5.80×10-3mol/L;实验①②的温度、CO和H2的起始浓度都相同,等质量催化剂的比表面积分别为82m2/g、124m2/g,所以这组实验的目的是探究等质量催化剂的比表面积不同时对合成甲醇化学反应速率的影响规律;(3)读图2,横纵坐标分别表示温度、CO转化率,当压强不变时,曲线表示CO的转化率随温度升高而降低;当温度不变时,由于正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,CO的平衡转化率增大,由此推断p2时曲线高于p1时曲线;(4)反应CO(g)+2H2(g) CH3OH(g)中出碳元素由+2降为—2,氢元素由0升为+1,说明CO得到电子,发生还原反应,而H2失去电子,发生氧化反应,因此负极的主要反应物和产物是氢气和水,由此先得出H2 —2e-→H2O;碱性条件下只能用氢氧根离子使左右电荷守恒,则H2 —2e-+2OH-→H2O;电极反应式遵循质量守恒定律,根据氢、氧原子个数守恒,则该电池负极反应式为H2 —2e-+2OH-=2H2O。
CH3OH(g)中出碳元素由+2降为—2,氢元素由0升为+1,说明CO得到电子,发生还原反应,而H2失去电子,发生氧化反应,因此负极的主要反应物和产物是氢气和水,由此先得出H2 —2e-→H2O;碱性条件下只能用氢氧根离子使左右电荷守恒,则H2 —2e-+2OH-→H2O;电极反应式遵循质量守恒定律,根据氢、氧原子个数守恒,则该电池负极反应式为H2 —2e-+2OH-=2H2O。

 图4-2 施工进度计划 施工过程中,发生如下事件。 事件1:施工单位有两台大型机械设备需要进场,施工单位提出应由建设单位支付其进场费,但建设单位不同意另行支付。 事件2:建设单位提供的材料运抵现场后,项目监理机构要求施工单位及时送检,但施工单位称:施工合同专用条款并未对此作出约定,因此,建设单位提供的材料,施工单位没有送检的义务,若一定要施工单位送检,则由建设单位支付材料检测费用。 事件3:当施工进行到第3个月末时,建设单位提出一项设计变更,使D工作的工程量增加2000m3。施工单位调整施工方案后,D工作持续时间延长1个月。从第4个月开始,D工作执行新的全费用综合单价。经测算,新单价中直接费为160元/m3,间接费费率为15%,利润率为5%,计税系数为3.14%。 事件4:由于施工机械故障,G工作的开始时间推迟了1个月。第6个月恰遇建筑材料价格大幅上涨,造成F、G工作的造价提高,造价管理部门公布的价格指数见表4-3。施工单位随即向项目监理机构提出了调整F、G工作结算单价的要求。经测算,F、G工作的单价中,钢材、水泥和骨料的价格所占比例均分别为25%、35%和10%。
图4-2 施工进度计划 施工过程中,发生如下事件。 事件1:施工单位有两台大型机械设备需要进场,施工单位提出应由建设单位支付其进场费,但建设单位不同意另行支付。 事件2:建设单位提供的材料运抵现场后,项目监理机构要求施工单位及时送检,但施工单位称:施工合同专用条款并未对此作出约定,因此,建设单位提供的材料,施工单位没有送检的义务,若一定要施工单位送检,则由建设单位支付材料检测费用。 事件3:当施工进行到第3个月末时,建设单位提出一项设计变更,使D工作的工程量增加2000m3。施工单位调整施工方案后,D工作持续时间延长1个月。从第4个月开始,D工作执行新的全费用综合单价。经测算,新单价中直接费为160元/m3,间接费费率为15%,利润率为5%,计税系数为3.14%。 事件4:由于施工机械故障,G工作的开始时间推迟了1个月。第6个月恰遇建筑材料价格大幅上涨,造成F、G工作的造价提高,造价管理部门公布的价格指数见表4-3。施工单位随即向项目监理机构提出了调整F、G工作结算单价的要求。经测算,F、G工作的单价中,钢材、水泥和骨料的价格所占比例均分别为25%、35%和10%。