化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ/mol。
356g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为 _______ 。
(2)某种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示),电池的电解质是掺入了Y2O3的ZrO2晶体,它在高温下传导O2-。
已知该电池负极的电极反应为:C4H10+2O2--4e-=CO2+H2O,则该电池正极的电极反应式为 _______ ,电池工作时,固体电解质里的O2-向 _______ 极移动。
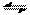 (3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
(3)已知一氧化碳与水蒸气的反应为:CO(g)+H2O(g) CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表: T℃时物质的浓度(mol/L)变化
| 时间 / min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
②已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 _______ 。
③397℃时该反应的平衡常数为12,请判断该反应的△H _______ 0(填“>”、“=”、“<”).
(1)1780.6 kJ (2)O2+4e-=2O2-; 负
(3)①增加H2浓度;增加H2O(g)浓度; 0.5 ② 75% ③ <
(1)356克可燃冰是2mol,放热890.3×2=1780.6。
(2)根据燃烧方程式推得总反应式为 C4H10+ 13/2 O2 → 4 CO2+ 5 H2O
减去负极反应式 C4H10+13O2--26e- 4CO2+5H2O
13/2 O2-(13O2--26e-)=0 整理得: O2+4e-=O2-
(3)①K= (0.1×0.1)/(0.1×0.2)="0.5" ;
②设:从起始到平衡CO的浓度变化为x mol·L -1
H2O (g) + CO (g)  H2(g)+ CO2 (g)
H2(g)+ CO2 (g)
起始:0.01 0.01 0 0
变化:x x x x
平衡:(0.01-x) (0.01-x) x x
则该温度下反应的平衡常数k = x2/(0.01-x)2=9,解得x =0.0075。转化率为75%。
③420℃时,该化学反应的平衡常数为9,397℃时该反应的平衡常数为12,平衡常数增大说明平衡正向移动,即降温平衡正向移动,正反应放热,△H<0。

 于乡里。年十六,乡人蔡道斑为湖阳戍主,道斑攻蛮锡城,反为蛮所困,道根救之。匹马转战,杀伤甚多,道斑以免,由是知名。
于乡里。年十六,乡人蔡道斑为湖阳戍主,道斑攻蛮锡城,反为蛮所困,道根救之。匹马转战,杀伤甚多,道斑以免,由是知名。
 睿围合肥,克之。六年,魏攻钟离,高祖复召睿救之,道根率众三千为睿前驱。至徐州,建计据邵阳洲,筑垒掘堑,以逼魏城。道根能走马步地,计马足以赋功,城隍立办。及淮水长,道根乘战舰,攻断魏连桥数百丈,魏军败绩。
睿围合肥,克之。六年,魏攻钟离,高祖复召睿救之,道根率众三千为睿前驱。至徐州,建计据邵阳洲,筑垒掘堑,以逼魏城。道根能走马步地,计马足以赋功,城隍立办。及淮水长,道根乘战舰,攻断魏连桥数百丈,魏军败绩。 靠给别人打工挣钱养母,所以在当地以孝出名。乡人蔡道斑任湖阳戍主时,攻打蛮锡城,没有想到反被蛮人围困,是道根救了他,由此道根更为出名。
靠给别人打工挣钱养母,所以在当地以孝出名。乡人蔡道斑任湖阳戍主时,攻打蛮锡城,没有想到反被蛮人围困,是道根救了他,由此道根更为出名。