(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨的原理是: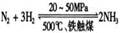 △H <0,生产流程如右图所示。
△H <0,生产流程如右图所示。
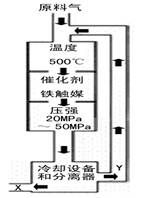
①X的化学式为 ;
②右图中条件选定的主要原因是(选填字母序号) ;
A.升高温度、增大压强均有利于提高氨的转化率
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③若升高温度,达新平衡时,平衡常数将__________(填增大或减小或不变)。
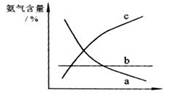
④改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) ;
(2)常温下氨气极易溶于水,其水溶液可以导电。
⑤用方程式表示氨气溶于水且显弱碱性的过程:
;
⑥氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
⑦将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为 。
(1)NH3 ② BC③减小④c ;a(2)⑤NH3 + H2O  NH3·H2O
NH3·H2O  NH4+ + OH-⑥ < ⑦ c(Cl-) > c(NH4+) > c(H+) > c(OH-)
NH4+ + OH-⑥ < ⑦ c(Cl-) > c(NH4+) > c(H+) > c(OH-)
本题考查工业合成氨。(1)②合成氨工业条件的选择,增大压强,加快反应速率,提高氨的产率,升高温度主要是考虑催化剂的活性,A错误,B正确;压强不能无限大,要考虑设备的承受能力,C正确;③升高温度,平衡逆向移动,平衡常数减小;④增大压强,平衡正向移动,氨气含量增大,c正确;升高温度,平衡逆向移动,氨气含量减小,a正确;(2)⑥氨水电离产生的OH-抑制水的电离;⑦相同体积、相同物质的量浓度的氨水和盐酸混合后完全反应,生成氯化铵溶液,NH4+水解而显酸性,离子浓度由大到小为c(Cl-) > c(NH4+) > c(H+) > c(OH-)。
