问题
选择题
工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)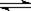 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
答案
答案:D
2SO2(g)+O2(g)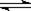 2SO3(g)
2SO3(g)
起始 2 1 0
转化 2x x 2x
平衡 2-2x 1-x 2x
由于平衡时压强减少30%,则(2-2x)+(1-x)+2x=3×70%
X=0.9mol
所以SO2的转化率为90%,反应放热为196.6×90%=176.94kJ,用SO2表示的5 min内的平均反应速率为1.8mol÷2L÷5min="0.18" mol·L—1.min—1
