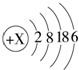
已知H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1,回答下列问题。
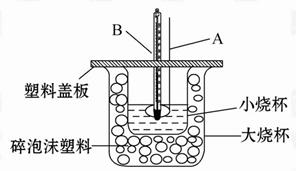
(1)仪器A的名称____ ___;碎泡沫塑料的作用是___________________。
(2)环形玻璃搅拌棒不能用环形铜质搅拌棒代替,其原因是______________ 。
(3)若通过实验测定中和热的ΔH的绝对值常常小于57.3 kJ/mol,其原因可能是_______
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(4)将V1mL1.0mol·L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。由下图可知,氢氧化钠的浓度为 ;
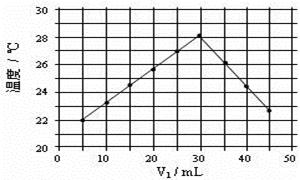
假设盐酸与氢氧化钠起始温度平均值为21.0℃,图中最高温度为28.0℃,并近似认为NaOH溶液和盐酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热ΔH = (取小数点后一位)。 (提示:Q=cmΔt)
(1)环形玻璃搅拌棒;保温隔离隔热作用。(2)铜棒易导致热量的散失。
(3)a、c、d (4) 1.5 mol·L-1-48.8 kJ·mol-1
题目分析:(1) 环形玻璃搅拌棒;保温隔离隔热作用。 (2) 铜棒易导致热量的散失。
(3)实验装置保温、隔热效果差导致一部分热量散失到外环境中。a正确
仰视读数时,实际取得的溶液量偏大,但加入烧杯中酸的量为定量,不影响ΔH。b错误
分多次把NaOH溶液倒入盛有盐酸的小烧杯中会导致盖板会被多次打开,热量散失。c正确
用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度会把盐酸带入NaOH溶液中,导致NaOH溶液不足。d正确
(4)如图,V1为30mL时温度最高,说明此时酸碱已经反应完毕,又实验中始终保持V1+V2=50mL,所以V2为20mL。酸碱中和可列式:30mL× 1mol·L-1= 20mL×CNaOH,可求NaOH的浓度是1.5 mol·L-1。由Q=cmΔt得,该反应放出热量 Q = 50g×4.18 J/(g·℃)×(28℃-21℃)=1463J,且该反应Q所放出的热量为形成30ml×1mol/L=0.03mol水所放出的热量,故中和热ΔH =-1.463kJ÷0.03mol=-48.8 kJ·mol-1