问题
填空题
从能量的变化和反应的快慢等角度研究反应: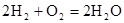 。
。
(1)为了加快正反应速率,可以采取的措施有________(填序号,下同)。
A.使用催化剂
B.适当提高氧气的浓度
C.适当提高反应的温度
D.适当降低反应的温度(2)已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
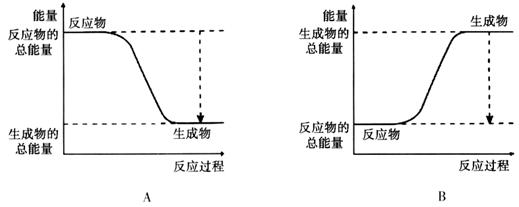
(3)从断键和成键的角度分析上述反应中能量的变化。
【资料】①键能:拆开1mol化学键需要吸收的能量,或是形成1mol化学键所放出的能量称为键能。
②化学键的键能:
| 化学键 | H—H | O=O | H—O |
键能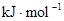 | 436 | 496 | 463 |
请填写下表:
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化 | |
| 拆开化学键 |  中的化学键 中的化学键 | _______________ | _______________ |
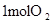 中的化学键 中的化学键 | |||
| 形成化学键 | 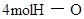 键 键 | _______________ | _______________ |
| 总能量变化 | _______________ | _______________ | |
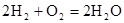 。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
。其中,氢气在________(填“正”或“负”)极发生________反应(填“氧化”或“还原”)。电路中每转移0.2mol电子,标准状况下消耗H2的体积是________L。
答案
(1)ABC (2)A
(3)
| 化学键 | 填“吸收”或“放出”能量 | 能量变化(kJ) | |
| 拆开化学键 | 2molH2中的化学键 | 吸收热量 | 1368 |
| 1molO2中的化学键 | |||
| 形成化学键 | 4molH-O键 | 放出热量 | 1852 |
| 总能量变化 | 放出热量 | 484 | |
(4)负 氧化 2.24
题目分析:(1)A、B、C均为增大反应速率的方法,D为减小反应速率。
(2)该反应为放热反应,反应物的总能量大于生成物的总能量。
(3)打破2molH2需要吸收2mol×436KJ/mol=872KJ;打破1molO2需要吸收1mol×496KJ/mol=496KJ
则共需要能量872KJ+496KJ=1368KJ能量;形成4molH-O键能够放出4mol×463KJ/mol=1852KJ;故总能量变化为1852KJ-1368KJ=484KJ。
(4)H2在反应中失去电子,为负极,发生氧化反应。 在燃料电池反应中,当电路转移0.2mol电子时,消耗0.1mol氢气,标况下,体积为2.24L。
