如图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓缓通入CO2气体。恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时,容器体积缩小至最小,为原体积的 。随着CO2的继续通入,活塞又逐渐向右移动。
。随着CO2的继续通入,活塞又逐渐向右移动。
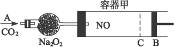
(1)①已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g。此时,通入标准状况下的CO2气体多少升?容器甲中NO2转化为N2O4的转化率是多少?
②活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至B处,则a值必小于0.01。其理由是_________________________________________________________________________。
(2)若改变干燥管中Na2O2的量,可通过调节甲容器的温度及通入CO2的量,使活塞发生从B到C,又从C到B的移动。则Na2O2的质量最小值应大于______________g。
(1)①1.792 L,25%
②活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向B移动,体积扩大,2NO2 N2O4平衡左移,使二者物质的量增多,活塞移至B时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol
N2O4平衡左移,使二者物质的量增多,活塞移至B时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol
(2)1.56
①设通入标准状况下CO2气体的体积为x,产生氧气的体积为y。
2Na2O2+2CO2====2Na2CO3+O2 Δm
2×22.4 L 22.4 L 56 g
x y 2.24 g
56 g·x=2×22.4 L×2.24 g x="1.792" L
y="0.896" L n(O2)="0.04" mol
2NO + O2 ="=== " 2NO2
2 1 2
0.1 mol>0.08 mol 0.04 mol 0.08 mol
所以NO过量,生成NO2的物质的量为0.08 mol。
所以2NO2 N2O4 Δn
N2O4 Δn
2 1
0.02 mol 0.1 mol×(1-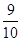 )
)
所以NO2转化为N2O4的转化率为 ×100%=25%
×100%=25%
(2)解:实现从B→C的移动,只能通过降温使2NO2 N2O4的平衡向右移动(此反应为放热反应)。
N2O4的平衡向右移动(此反应为放热反应)。
即降温时 2NO2 N2O4 Δn
N2O4 Δn
2 1 1
0.02 mol 0.1 mol×(1-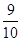 )
)
即容器中至少应有0.02 mol的NO2,根据转化关系式可知:
2Na2O2—O2—2NO—2NO2
至少需要Na2O2 0.02 mol
所以其质量最小值为0.02 mol×78 g·mol-1="1.56" g。
同步测控
