合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)= 。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)  N2(g)+3H2(g)的平衡常数K= 。
N2(g)+3H2(g)的平衡常数K= 。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为 (填选项字母)。
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286kJ/mol,则陪制NH3反应的热化学方程式为 。
(3)采用高质子导电性的SCY陶瓷(能传递H'),通过电解法也可合成氨,原理为:
N2(g)+3H2(g)  2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
(1)①0.075 mol·L-1·h-1 ②20% 69.12 ③C D
(2)2 N2(g) + 6 H2O (l) =" 4" NH3(g) + 3 O2 (g) ΔH =" +1530" kJ·mol-1
(3)阴 N2 + 6 H+ + 6e- = 2NH3
|
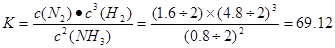 。③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同,则应该一边倒转化,得到的N2物质的量为2mol,H2的物质的量为6mol,NH3的物质的量为0mol。可知C、D符合要求。选项为C、D。①N2(g)+3H2(g)
。③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同,则应该一边倒转化,得到的N2物质的量为2mol,H2的物质的量为6mol,NH3的物质的量为0mol。可知C、D符合要求。选项为C、D。①N2(g)+3H2(g)  2NH3(g)∆H=-93.0KJ/mol; ②2H2(g)+O2(g)=2H2O(l) ∆H=-572KJ/mol.①×2-②×3.整理可得:2 N2(g) + 6 H2O (l) =" 4" NH3(g) + 3 O2 (g) ΔH =" +1530" kJ/mol。(3)因为N2在反应中得到电子,化合价降低,所以应该把N2不断地通入阴极。电极反应式为N2 + 6 H+ + 6e- = 2NH3。考点:
2NH3(g)∆H=-93.0KJ/mol; ②2H2(g)+O2(g)=2H2O(l) ∆H=-572KJ/mol.①×2-②×3.整理可得:2 N2(g) + 6 H2O (l) =" 4" NH3(g) + 3 O2 (g) ΔH =" +1530" kJ/mol。(3)因为N2在反应中得到电子,化合价降低,所以应该把N2不断地通入阴极。电极反应式为N2 + 6 H+ + 6e- = 2NH3。考点: 