对于CO(g)+H2O(g) CO2(g)+H2(g),起始时只有CO、H2O(g)且浓度都是4 mol·L-1,达到平衡时,CO的浓度为1 mol·L-1;将H2O(g)的浓度提高到3 mol·L-1,平衡时CO的浓度为0.53 mol ·L-1。求:两次平衡时CO、H2O的转化率和CO2在平衡混合物中百分含量。
CO2(g)+H2(g),起始时只有CO、H2O(g)且浓度都是4 mol·L-1,达到平衡时,CO的浓度为1 mol·L-1;将H2O(g)的浓度提高到3 mol·L-1,平衡时CO的浓度为0.53 mol ·L-1。求:两次平衡时CO、H2O的转化率和CO2在平衡混合物中百分含量。
CO转化率=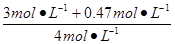 ×100%=86.75%,
×100%=86.75%,
H2O(g)转化率=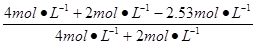 ×100%=57.8%,
×100%=57.8%,
w(CO2)=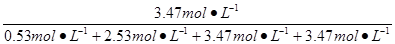 ×100%=34.7%。
×100%=34.7%。
。
第一次平衡过程:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度/mol·L-1 4 4 0 0
转化浓度/mol·L-1 3 3 3 3
平衡浓度/mol·L-1 1 1 3 3
CO转化率=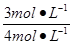 ×100%=75%,
×100%=75%,
H2O(g)转化率=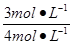 ×100%=75%,
×100%=75%,
w(CO2)=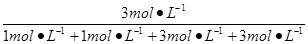 ×100%=37.5%。
×100%=37.5%。
第二次平衡过程:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度/mol·L-1 1 3 3 3
转化浓度/mol·L-1 0.47 0.47 0.47 0.47
平衡浓度/mol·L-1 0.53 2.53 3.47 3.47
CO转化率=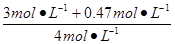 ×100%=86.75%,
×100%=86.75%,
H2O(g)转化率=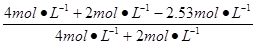 ×100%=57.8%,
×100%=57.8%,
w(CO2)=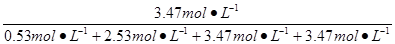 ×100%=34.7%。
×100%=34.7%。
