问题
选择题
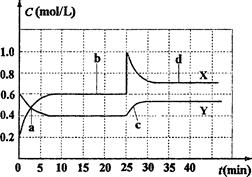
A.图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化
B.a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C.反应进行至25 min时,曲线发生变化的原因是加入0.4molN2O4
D.若要达到与d相同的状态,在25 min时还能采取的措施是适当缩小容器体积
答案
答案:C
本题结合图象考查化学平衡理论、化学反应速率知识,关键在于明确勒沙特列原理及反应速率理论。从图象可以看出,Y线达平衡时变化量为0.2 mol·L‑1,X线达平衡时变化量为0.4 mol·L‑1,故X表示NO2浓度随时间的变化,A正确;图中a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d, a、c未达平衡,B正确;反应进行至25 min时,曲线发生变化的原因是加入0.4molNO2,故C错;缩小容器体积,压强增大,平衡向体积缩小的方向移动,故D正确。
