(6分)1 000 ℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应达到平衡:
Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g);ΔH>0
Na2S(s)+4H2O(g);ΔH>0
若反应在恒温恒容状态下进行,回答以下问题:
(1)向容器中分别加入以下物质,判断对平衡有无影响,有影响的应填写出平衡移动的方向。
①加入
Na2SO4___________________________________________________________________。
②加入焦炭
_____________________________________________________________________。
(2)若将容器温度升高20 ℃,H2在混合气体中的含量变化用下图中______图表示最合适。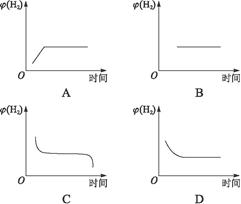
(1)①无影响 ②有影响,正向移动 (2)D
(1)对于已处于化学平衡状态的体系,固体反应物的量对平衡无影响,故加入Na2SO4固体时平衡不移动。但加入固体焦炭时,由于体系温度为1000 ℃,会发生如下反应:
C+H2O(g) CO+H2
CO+H2
使原平衡体系中的c(H2O)减小,c(H2)增大,平衡向右移动。
(2)若升高温度,由于原平衡的反应为吸热反应,故平衡向正反应方向移动,φ(H2)的含量应逐渐减少,直至达到新的平衡。分析A、B、C、D的曲线走向,唯D项正确。
常见错解:因未意识到1000 ℃时焦炭与水蒸气的反应,而仅仅认为焦炭是与该反应无关的固体,从而得出焦炭的加入对原平衡无影响的错误结论。
