一定条件下,在体积为3 L的密闭容器中反应:CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
(1)该反应的平衡常数表达式K= ;根据下图,升高温度,K值将 (填“增大”、“减小”或“不变”)。
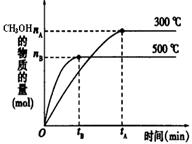
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 (用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a、CO、H2、CH3OH的浓度均不再变化
b、混合气体的密度不再改变
c、混合气体的平均相对分子质量不再改变
d、v生成(CH3OH)= v消耗(CO)
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a、c(H2)减少
b、正反应速率加快,逆反应速率减慢
c、CH3OH 的物质的量增加
d、重新平衡时c(H2)/ c(CH3OH)减小
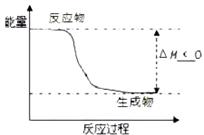
(5)根据题目有关信息,请在右下坐标图中标示出该化学反应过程的能量变化(标明信息)。
(6)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:2CH3OH–12e-+16OH-= 2CO32-+ 12H2O ,则正极上发生的电极反应为: 。
(1)c(CH3OH)/c(CO)·c2(H2)(2分);减小(2分)
(2) 2nB/3tBmol·L-1·min-1(2分)
(3)a、c(2分)
(4)c、d(2分)
(5)如图(3分)
(6)3O2+6H2O+12e-=12OH-(3分)
题目分析:(1)根据已知方程式不难得出该反应的平衡常数表达式为:c(CH3OH)/c(CO)·c2(H2);根据图像,平衡时500℃下产物甲醇的物质的量小于300℃时的甲醇物质的量,所以随着温度升高平衡逆向移动,说明该反应的K值将减小,该正反应是放热反应△H<0。
(2)500℃时,从反应开始到达到化学平衡,反应用时tB 分钟,生成甲醇nB mol,所以反应速率v(H2)=2v(CH3OH)= 2nB/3tBmol·L-1·min-1 。
(3)反应中各组分的浓度不变时判断可逆反应达到平衡的重要标志,A正确;混合气体密度ρ=m/V,由于参加反应的物质都是气体,质量守恒,混合气体质量始终不变,所以在恒容密闭容器中混合气体密度始终不变,所以不能判断是否达到平衡,B错误;混合气体的平均相对分子质量M= m/n,气体质量不变,但是气体的总物质的量随反应进行而改变,所以M会发生改变,当M不变时,反应达到平衡,C正确;生成甲醇和消耗CO表示的都是正反应速率,所以D项不能判断反应达到平衡;故选AC。
(4)压缩容器为原来的1/2,则个物质的浓度均瞬间增大1倍,压强增大,平衡向右移动,虽然平衡向右移动H2浓度减小,但是体积改变使氢气浓度增大影响更大,所以c(H2)增大,a错误;增大压强,正逆反应速率均增大,只是正反应速率增大较多,b错误;平衡右移,甲醇物质的量增大,c正确;重新达到平衡,c(H2)将小于原来浓度的2倍,c(CH3OH)将大于原来浓度的2倍,所以c(H2)/ c(CH3OH)将减小,d正确。故选cd。
(5)根据题目的有信息和上述的分析,该反应△H<0,所以画出该反应的能量变化情况只要注意焓变和相应标示即可。

(6)以甲醇作燃料的电池,甲醇做负极失去电子被碱吸收形成CO32-,氧气做正极得到电子被还原,所以在给出总反应式和负极反应式的情况下,不难得到正极反应式为3O2+6H2O+12e-=12OH-。
