科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g) 2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
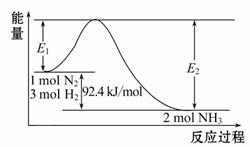
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的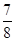 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
A.向容器中按原比例再充入原料气
B.向容器中再充入一定量H2
C.改变反应的催化剂
D.液化生成物分离出氨(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)
ΔH="+1" 530 kJ/mol
又知:H2O(l) H2O(g) ΔH="+44.0" kJ/mol
H2O(g) ΔH="+44.0" kJ/mol
则2N2(g)+6H2O(g) 4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
(1)①减小 ②30% A、D
(2)+1 266 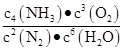 不变
不变
(1)①在反应体系中加入催化剂,活化能降低,E2也减小,反应速率增大。
② N2 + 3H2  2NH3
2NH3
起始 0.3 mol 0.5 mol 0
转化 x mol 3x mol 2x mol
平衡 (0.3-x)mol (0.5-3x)mol 2x mol
根据题意有(0.3-x)mol +(0.5-3x)mol+ 2x mol=0.7,解得x=0.05,H2转化
0.15 mol,转化率为30%。
欲提高转化率可以按原比例向容器中再充入原料气(相当于加压),液化生成物分离出氨,也可以降温。
(2)由盖斯定律消去H2O(l)可得,2N2(g) + 6H2O(g) 4NH3(g)+3O2 (g)
4NH3(g)+3O2 (g)
ΔH ="+1" 266 kJ·mol-1。
该反应的平衡常数表达式可以表示为K= K只受温度的影响,控制其他条件不变,增大压强,K值不变
K只受温度的影响,控制其他条件不变,增大压强,K值不变
