问题
计算题
在127℃和1.0×105Pa时,向某容器中放入18.4gN2O4使之发生反应N2O4 2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
(1)N2O4的分解率;
(2)平衡混合物的平均分子量。
答案
(1)N2O4的分解率为50%;
(2)平衡时混合气体的平均分子量为61.33。
依题意nN2O4=(18.4g)/92g/mol=0.2mol
平衡混合气密度比原来减少1/3
∴(n起始/n平衡)=(ρ平衡/ρ起始)
=(2/3/1)=(2/3)
则有:n平衡=(3/2)n起始=(3/2)×0.2mol=0.3mol
(1)设N4O4分解率为x,则有:
N2O4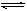 2NO2Δn
2NO2Δn
121
0.2xmol(0.3mol-0.2mol)
解得x=(0.1mol/0.2mol)=0.5=50%
(2)m总=18.4g
n总=0.3mol
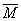 =(m总/n总)=(18.4/0.3)=61.33
=(m总/n总)=(18.4/0.3)=61.33
