下列说法正确的是
A.常温下,物质的量浓度均为0.1mol·L−1Na2CO3和NaHCO3的等体积混合溶液中:
2c(OH−)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32−)
B.ΔH<0,ΔS>0的反应都是自发反应,ΔH>0,ΔS>0的反应任何条件都是非自发反应;
C.已知:P4(g)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(g)+10Cl2(g)=4PCl5(g)ΔH=bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1,由此计算Cl-Cl键的键能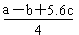

D.在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)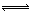 2SO3(g)△H<0,当v(SO2)= v(SO3)时,说明该反应已达到平衡状态
2SO3(g)△H<0,当v(SO2)= v(SO3)时,说明该反应已达到平衡状态
答案:A
题目分析:A、根据质子守恒,对于Na2CO3溶液:c(OH−)=c(H+)+2c(H2CO3)+c(HCO3-);对于NaHCO3溶液:c(OH−)+c(CO32−)=c(H+)+c(H2CO3);两者等浓度、等体积混合后,溶液中两种溶质的物质的量相等,所以,将上述两式叠加:[c(OH−)=c(H+)+2c(H2CO3)+c(HCO3-)]+[ c(OH−)+c(CO32−)=c(H+)+c(H2CO3)],移项,即得2c(OH−)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32−),正确;B、ΔH>0,ΔS>0 在较高温度下能自发,错误;C、将两个反应式分别编号为①和②,(② - ①)÷4可得:PCl3(g)+Cl2(g)= PCl5(g) ;ΔH=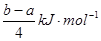 。由:
。由:
PCl3(g) + Cl2(g) = PCl5(g)
断1个P-Cl键 断1个Cl-Cl键 成1个P-Cl键
3×1.2c Q 5×c
(3.6c + Q -5c)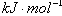 =
=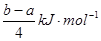 , Q=
, Q=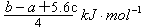 ,故C错。
,故C错。
D选项,不同物质表示速率,到达平衡时,正逆速率之比等于化学计量数之比,如,V正(SO2):V逆(SO3)=" 2" : 2,即V正(SO2)=V逆(SO3)。而对v(SO2)=v(SO3)未指明反应速率的方向,故错误;
