工业上常常利用反应①来生产环氧乙烷,但是伴随副反应②。
①C2H4(g)+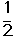 O2(g) →
O2(g) →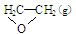 ; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
; △H1 ②C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g); △H2
(1)写出环氧乙烷充分燃烧的热化学反应方程式。答:____________________________;
(2)工业生产中,可通过某一措施来加快反应①而对反应②影响较小,从而提高环氧乙烷的生产效率。工业生产采取的这种措施是_______________。
A.升高反应体系的温度B.增大体系中氧气的浓度
C.使用合适的催化剂D.降低反应体系的压强
(3)已知C=C、O=O、C—C键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,则环氧乙烷中C—O键能为 kJ·mol-1;
(4)反应②可以设计成燃料电池,若以酸做电解质溶液,负极反应式是 。
(1)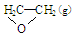 +2.5 O2(g) =" 2" CO2 (g) +2 H2O(g) △H=△H2-△H1 (2)C
+2.5 O2(g) =" 2" CO2 (g) +2 H2O(g) △H=△H2-△H1 (2)C
(3)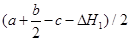 (4)C2H4 - 12e- + 4 H2O =" 2" CO2 +12 H+
(4)C2H4 - 12e- + 4 H2O =" 2" CO2 +12 H+
题目分析:(1)②-①。整理可得环氧乙烷充分燃烧的热化学反应方程式: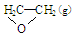 +2.5 O2(g) =" 2" CO2 (g) +2 H2O(g) △H=△H2-△H1。(2)由于①的正反应是个气体体积减小的放热反应,而②是个气体体积不变的放热反应。A.升高反应体系的温度,①、②两个反应速率都加快。不符合题意。错误。B.增大体系中氧气的浓度,由于反应物的浓度增大,所以反应速率都加快。不符合题意。错误。C.催化剂只能对某一反应发生影响,而对其它反应没有影响。所以使用合适的催化剂,能加快反应①而对反应②影响较小,从而提高环氧乙烷的生产效率。符合题意,正确。D.降低反应体系的压强,由于两个反应的物质浓度都减小,所以反应速率都减慢。错误。正确选项为C。(3)反应热就是断键吸收的热量与形成键释放的热量的差值。将C=C、O=O、C—C键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,代入①,整理可得环氧乙烷中C—O键能为
+2.5 O2(g) =" 2" CO2 (g) +2 H2O(g) △H=△H2-△H1。(2)由于①的正反应是个气体体积减小的放热反应,而②是个气体体积不变的放热反应。A.升高反应体系的温度,①、②两个反应速率都加快。不符合题意。错误。B.增大体系中氧气的浓度,由于反应物的浓度增大,所以反应速率都加快。不符合题意。错误。C.催化剂只能对某一反应发生影响,而对其它反应没有影响。所以使用合适的催化剂,能加快反应①而对反应②影响较小,从而提高环氧乙烷的生产效率。符合题意,正确。D.降低反应体系的压强,由于两个反应的物质浓度都减小,所以反应速率都减慢。错误。正确选项为C。(3)反应热就是断键吸收的热量与形成键释放的热量的差值。将C=C、O=O、C—C键能分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1,代入①,整理可得环氧乙烷中C—O键能为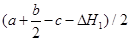 。(4)若把反应C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g)设计成原电池。则通入C2H4的电极为负极,通入O2的电极为正极。因为是以酸做电解质溶液,所以负极反应式是C2H4 - 12e- + 4 H2O =" 2" CO2 +12 H+,正极的电极式是O2 +4e-+ 4H+= 2H2O.
。(4)若把反应C2H4(g)+3O2(g) → 2CO2(g)+2H2O(g)设计成原电池。则通入C2H4的电极为负极,通入O2的电极为正极。因为是以酸做电解质溶液,所以负极反应式是C2H4 - 12e- + 4 H2O =" 2" CO2 +12 H+,正极的电极式是O2 +4e-+ 4H+= 2H2O.
