在一定条件下,甲醇存在化学平衡:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH="-25" kJ/mol,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如表:
CH3OCH3(g)+H2O(g) ΔH="-25" kJ/mol,某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如表:
| 物质 | CH3OH | CH3OCH3 | H2O |
| C/(mo/L) | 0.8 | 1.24 | 1.24 |
A.平衡时CH3OH的 物质的量浓度为0.8mol/L
B.升高温度,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.从此时刻到平衡时,反应放出热量9 kJ
D.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率减小
答案:C
题目分析:A、反应进行到c(CH3OH)=0.8mol•L‾1时,浓度商Q=1.24×1.24÷0.82="2.4" < K,反应还未达到平衡,所以平衡浓度应大于0.8mol•L‾1,错误;B、升高温度,正反应速率和逆反应速率都增大,错误;C、设达到平衡后,CH3OH继续转化的浓度为2xmol/L,根据三段式进行计算:
2CH3OH(g)  CH3OCH3(g) + H2O(g)
CH3OCH3(g) + H2O(g)
某时刻 0.8 mol·L-1 1.24 mol·L-1 1.24 mol·L-1
变化 2x mol·L-1 x mol·L-1 x mol·L-1
平衡 (0.8-2x) mol·L-1 1.24+x mol·L-1 1.24+x mol·L-1
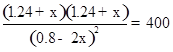 ,解得x="0.36" mol/L,平衡时,反应物甲醇蒸气又消耗掉0.72 mol,放出热量为12.5 kJ/mol×0.72 mol="9" kJ,正确;D、平衡时,再加入与起始等量的CH3OH,达新平衡时与原平衡等效,CH3OH转化率不变,错误。
,解得x="0.36" mol/L,平衡时,反应物甲醇蒸气又消耗掉0.72 mol,放出热量为12.5 kJ/mol×0.72 mol="9" kJ,正确;D、平衡时,再加入与起始等量的CH3OH,达新平衡时与原平衡等效,CH3OH转化率不变,错误。
