(14分)
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)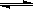 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示:
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示:
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。

(2)在压强为0.1 MPa条件下, a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)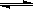 CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
③该反应的△H 0,△S 0(填“<”、“>”或“=”)。
④若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2(3)在最新开发并投入生产的流动电解质直接甲醇燃料电池中,流动电解质硫酸的使用,可提高燃料电池效率约30%,该电池的负极反应为 。
(1)①0.0030mol·L-1·min-1(2分) ② <(2分); 2.25×10-4(2分)
(2)③<(2分)<(2分) ④ BD (2分)
(3)CH3OH + H2O - 6e- = CO2 + 6H+ (2分)
