(16分)尿素可作为H2O2的稳定载体,生产一种固态、耐储存、易运输的新型氧化剂和消毒剂—过氧化尿素[CO(NH2)2·H2O2],其合成工艺流程如下:
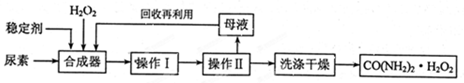
请回答下列问题:
(1)操作I、II的名称分别是______、_______。CO(NH2)2·H2O2分子中尿素和过氧化氢之间以________结合,其结合力较弱,具有尿素和过氧化氢双重性质。
(2)工业上生产尿素所需的原料气可由天然气与水反应制备,已知:
①甲烷、氢气的燃烧热分别为890.3KJ/mol、285.8kJ/mol
②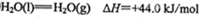
写出CH4与水蒸气作用生产CO2和H2的热化学方程式:_______________。
(3)合成过氧化氢尿素加入的稳定剂可以是水杨酸、酒石酸等。酒石酸分子式为C4H6O6,其核磁共振氢谱只有3种锋,只含羧基和羟基两种官能团,则酒石酸的结构简式为_____。
(4)为测定产品中H2O2的含量,称取干燥样品12.0g配成250mL溶液,取25.00mL
于锥形瓶中,加入适量硫酸酸化,用0.20mol/LKMnO4标准溶液滴定,三次滴定平均消耗KMnO4溶液20.00mL.(KMO4溶液与尿素不反应).
①完成并配平方程式: MnO4-+
MnO4-+  H2O2+
H2O2+  _________=Mn2++
_________=Mn2++ O2↑+
O2↑+ ___;
___;
②计算出产品中H2O2的质量分数为_______。
(5)电解尿素的废水既可以处理废水,又可制得纯氢,电解原理如图所示。电解池中隔膜仅阻止气体通过,B两极均为惰性电极。B极连接电源的____极(填
“正”或“负”),阳极电极反应方程为_____________。
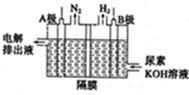
(16分)
(1)低温蒸发、过滤(2分) 氢键(1分)
(2)CH4(g)+2H2O(g)==CO2(g)+4H2(g) DH=+164.9 kJ/mol(3分)
(3)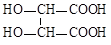 (2分)
(2分)
(4)①2MnO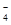 +5H2O2+6H+==2Mn2++5O2↑+8H2O(2分) ②28.3 %(2分)
+5H2O2+6H+==2Mn2++5O2↑+8H2O(2分) ②28.3 %(2分)
(5)负(2分) CO(NH2)2-6e-+8OH- == N2↑+CO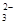 +6H2O(2分)
+6H2O(2分)
题目分析:(1)因为过氧化尿素具有尿素和过氧化氢双重性质,受热易分解,所以应使溶液在较低温度下蒸发,因此操作I、II的名称分别是低温蒸发、过滤;CO(NH2)2·H2O2分子中尿素和过氧化氢都已经达到稳定结构,二者之间的结合力较弱,应该为氢键。
(2)首先写出CH4与H2O反应的化学方程式并注明状态,然后根据盖斯定律求焓变,∆H=—890.3kJ•mol‾1+4×285.8kJ•mol‾1—2×44kJ•mol‾1 =+164.9 kJ•mol‾1,可得热化学方程式。
(3)酒石酸只含羧基和羟基两种官能团,根据不饱和度,应含有2个羧基和2个羟基,核磁共振氢谱只有3种锋,说明H原子位置只有3种,为对称结构,所以结构简式为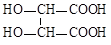
(4)①根据氧化还原反应中,化合价升高的价数和降低相等,MnO4‾中Mn元素降低5价,H2O2中O元素升高1价,所以MnO4‾和Mn2+的系数为2,H2O2和O2的系数为5,然后利用观察法配平化学方程式。
②根据反应时KMnO4与H2O2的物质的量之比为2:5,可得产品中H2O2的质量分数=0.2mol/L×0.02L×5/2×10×34g/mol÷12g×100% =28.3%
(5)根据图示,B极发生H+得电子生成H2,所以B为阴极,连接电源的负极;阳极CO(NH2)2失去电子转化为N2,因为电解液含KOH,所以电极方程式为:CO(NH2)2-6e-+8OH- == N2↑+CO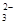 +6H2O
+6H2O
