问题
选择题
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是
A.2SO3(g)  2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1
2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1
B.2SO2(g)+O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1
SO3(g)ΔH=-98.3 kJ·mol-1
C.SO2(g)+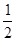 O2(g)
O2(g) SO3(g)ΔH=+98.3 kJ·mol-1
SO3(g)ΔH=+98.3 kJ·mol-1
D.SO2(g)+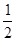 O2(g)
O2(g) SO3(g)ΔH=-196.6 kJ·mol-1
SO3(g)ΔH=-196.6 kJ·mol-1
答案
答案:A
从原料的量、SO2的转化率为50%可知,1 mol SO2完全反应放出热量98.3 kJ,故热化学方程式为SO2(g)+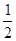 O2(g)
O2(g) SO3(g) ΔH=-98.3 kJ·mol-1,从而判断出选项B、C、D都错;SO2氧化为SO3的反应放热,故SO3分解过程为吸热,可得2SO3(g)
SO3(g) ΔH=-98.3 kJ·mol-1,从而判断出选项B、C、D都错;SO2氧化为SO3的反应放热,故SO3分解过程为吸热,可得2SO3(g)  2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1。
2SO2(g)+O2(g) ΔH=+196.6 kJ·mol-1。
