(14分)合成氨对工、农业生产和国防都有重要意义。
已知:N2(g)+3H2(g)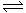 2NH3(g);△H= -92.4 kJ·mol-1,请回答:
2NH3(g);△H= -92.4 kJ·mol-1,请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是_____(填字母)。
a.用铁触媒(催化剂)加快化学反应速率
b.采用较高压强(20 MPa~50 MPa)
c.将原料气中的少量CO等气体净化除去
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积V恒定,达到平衡时,气体的压强为原来的 ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2__а1(填“>、<或=”)。
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。钯电极A是电解池的____极(填“阳”或 “阴”),该极上的电极反应式是 。

(14分)
(1)bd (2分)(2)① 25%(2分) 23.1 kJ(2分) ② >(2分) K=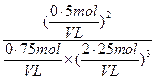 (2分)
(2分)
(3)阴(2分) N2+ 6H+ + 6e-= 2NH3(2分)
