问题
选择题
含氮废水中的NH4+在一定条件下可与O2发生以下反应:
① NH4+(aq) +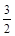 O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
O2(g) = NO2-(aq) + 2H+(aq) + H2O(l) ΔH = -273kL/mol
② NO2-(aq) +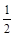 O2(g) = NO3-(aq) ΔH = -73kL/mol
O2(g) = NO3-(aq) ΔH = -73kL/mol
下列叙述不正确的是
A.升高温度,可使①②反应速率均加快
B.室温下时0.1 mol/L HNO2(aq) pH>1,则NaNO2溶液显碱性
C.NH4+(aq) + 2O2(g) = NO3-(aq) + 2H+(aq) + H2O(l)ΔH = -346kJ/mol
D.1 mol NH4+在①反应中与1 mol NO2-在②反应中失电子数之比为1:3
答案
答案:D
A.任何化学反应,升高温度,反应速率均加快,正确。B.HNO2若为强酸,则在室温下时0.1 mol/L HNO2(aq) pH=1,而现在pH>1则说明HNO2是弱酸,NaNO2是强碱弱酸盐,水解使溶液显碱性,正确。C. ①+②足量可得NH4+(aq) + 2O2(g) = NO3 -(aq) + 2H+(aq) + H2O(l) ΔH = -346kJ/mol,正确。D.1 mol NH4+在①反应中失去电子6mol; 1 mol NO2-在②反应中失电子数2mol。因此失去电子的物质的量的比为3:1,错误。
