乙醇汽油含氧量达35%,使燃料燃烧更加充分,使用车用乙醇汽油,尾气排放的CO
和碳氢化合物平均减少30%以上,有效的降低和减少了有害的尾气排放。但是汽车使用乙醇汽油并不能减少NOx的排放,对NOx的有效消除成为环保领域的重要课题。NOx排入空气中,形成酸雨,造成空气污染。NOx中有一种红棕色气体,其溶于水的方程式是 。
(2)已知NO2和N2O4的结构式分别是  和
和 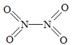 。
。
| 物质 | NO2 | N2O4 | |
| 化学键 | N=O | N—N | N=O |
| 键能(kJ/mol) | 466 | 167 | 438 |
(3)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
①写出用CO还原NO生成N2的化学方程式 。
②在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
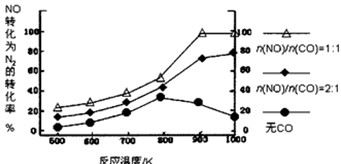
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别为 、 ;该反应的∆H 0(填“>”、“<”或“=”)。
(4)用 CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO 发生反应的化学方程式为 。
(1)3NO2+H2O=2HNO3+NO
(2)2NO2(g) = N2O4(g) ∆H=-55 kJ/mol
(3)① 2CO+2NO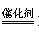 N2+2CO2
N2+2CO2
②900K; n(NO)/n(CO)=1∶1;>
(4)CH4+4NO 2N2+CO2+2H2O
2N2+CO2+2H2O
(1)二氧化氮与水反应方程式为,3NO2+H2O=2HNO3+NO。
(2)二氧化氮转化为四氧化二氮的反应热可通过键计算出∆H=2×2×466-(4×436+167)=-55kJ/mol,2NO2(g) = N2O4(g) ∆H=-55 kJ/mol;
(3)① 2CO+2NO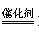 N2+2CO2
N2+2CO2
②由图可知,900K时转化率达到100%,此时n(NO)/n(CO)=1∶1,随着温度升高,NO的转化率增大,说明升高向正向移动,正反应是吸热反应,∆H>0;
(4)无污染生成,则CH4+4NO 2N2+CO2+2H2O。
2N2+CO2+2H2O。