(15分)
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
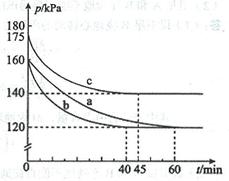
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、
c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
;实验a和c的平衡转化率:αa为 、αc为 。
⑴AX3(l)+X2(g) = AX5(s) ΔH=-123.8KJ·mol-1(2分)
⑵①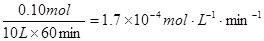 (3 分)
(3 分)
②bca(2分) b、加人催化剂。反应速率加快,但平衡点没有改变(2分)
c、 温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)(2分)
③α=2(1-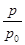 ) (2分) 50%(1分) 40% (1分)
) (2分) 50%(1分) 40% (1分)
题目分析:⑴据题意,先写出反应方程式并标出各物质的状态AX3(l)+X2(g) = AX5(s),然后确定其反应热ΔH=-123.8KJ·mol-1,综上便可写出完整的热化学方程式。
⑵①
解:开始时no =" 0.4" mol,总压强为160 kPa,平衡时总压强为120 kPa,
则n为: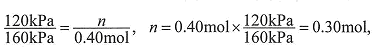
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始时no/mol: 0.20 0.20 0
平衡时n/mol:: 0.20 -x 0.20 -x x
(0.20-x)+(0.20-x)+x = 0.30
x = 0.10
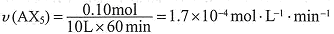
②从图中观察平衡的时间(tb<tc<ta),判断反应速率的快慢为b>c>a;
b组的反应速率加快,但平衡点没有改变说明是加人了催化剂;
c组的反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)说明是温度升高。
③用三段式分析:
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始时no/mol: 0.20 0.20 0
变化量n/mol:: 0.20α 0.20α 0.20α
平衡时n/mol:: 0.20 -0.20α 0.20 -0.20α 0.20α
据题意有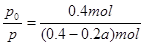 ,化简得α=2(1-
,化简得α=2(1-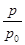 );
);
将图中p0、p的数据代入上述计算式得αa=2(1-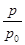 )=2(1-
)=2(1-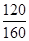 )=50%;
)=50%;
αc=2(1-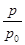 )=2(1-
)=2(1-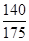 )=40%。
)=40%。
